کانیهای سیلیکات از ترکیب شدن سیلیسیم، اکسیژن و یک یا چند فلز به دست میآیند و به دو دستهٔ سیلیکاتهای تیره(دارای آهن و منیزیم) و سیلیکاتهای روشن (بدون آهن و منیزیم) تقسیم میشود. الیوین، پیروکسین، آمفیبول، میکای سیاه، تورمالین، تالک، سرپانتین و آزبست، نمونههایی از دستهٔ نخست و کوارتز، فلدسپات، میکای سفید و کائولینیت، نمونههایی از دستهٔ دوم هستند.
کوچکترین واحد سازندهٔ سیلیکاتها به شکل یک هرم چهاروجهی است که سطوح آن را مثلثهای متساوی الاضلاع تشکیل میدهند.
این بنیانهای چهاروجهی سیلیکات، بار الکتریکی منفی دارند و باید یکدیگر را دفع کنند ولی در ساختمان بلورین کانیها، این بنیانها به وسیلهٔ یونهای مثبتی چون آلومینیم، آهن، منیزیم و ... طوری به یکدیگر پیوند داده شدهاند که واحد سازندهٔ بلوری در مجموع دارای بار خنثی است. یونهای پیوند دهندهٔ بنیانها دارای اندازه و بار الکتریکی متفاوتند.
به طور کلی یونهای تقریباً هماندازه میتوانند جانشین یکدیگر شوند (آهن و منیزیم که شعاع یونی نزدیک به هم دارند با سدیم و کلسیم که جای یکدیگر را در ساختمان بلورین کانی اشغال میکنند) این وضع تغییر مهمی را در ساختمان کانی به وجود نمیآورد. جدای از دستهبندی کانیها بر اساس رنگ و تیرگی یا روشنی آنها، کانیهای سیلیکاتی براساس ساختار بلوریشان به ۶ زیرشاخه تقسیم میشوند.
دید کلی
در تمام ساختمانهای سیلیکاتی بررسی شده (بجز آنهایی که در فشارهای فوقالعاده زیاد تشکیل میشوند) سیلیسیوم بین چهار اتم اکسیژن قرار میگیرد. به نظر میرسد این ترتیب قرار گرفتن سیلیسیوم در ترکیبات سیلیکاتی جهان شمول باشد. زیرا پیوند بین سیلیسیوم _ اکسیژن آنقدر قوی است که چهار اتم اکسیژن همیشه در گوشههای چهار وجهیای دیده میشوند که صرفنظر از شکل مابقی ساختمان همیشه دارای ابعاد ثابت و شکل منظمی است. سیلیکاتها از راههای گوناگونی که این چهار وجهیهای سیلیسیوم _ اکسیژن به یکدیگر مربوط میشوند، تشکیل میگردند. این چهار وجهیها ممکن است به صورت واحدهای جدا و مشخص حضور داشته باشند، یا ممکن است از طریق به اشتراک گذاشتن گوشهها (یا عبارت دیگر اکسیژن) به یکدیگر متصل شوند.طبقه بندی سیلیکاتها بر اساس انواع اتصالها
-
گروههای چهار وجهی مستقل :
در این نوع ساختمان چهار وجهیهای سیلیسیوم _ اکسیژن به صورت محدودههای جدا و مستقل حضور دارند. ساختمان حاصل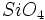 است و کانی تیپیک این گروه فورستریت به فرمول
است و کانی تیپیک این گروه فورستریت به فرمول 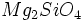 است. این گروه از سیلیکاتها به نزوسیلیکاتها (Nesosilicates) شهرت یافتهاند.
است. این گروه از سیلیکاتها به نزوسیلیکاتها (Nesosilicates) شهرت یافتهاند.
-
گروههای چهار وجهی با اتصال محدود :
در این نوع سیلیکاتها ، چهار وجهیهای سیلیسیوم _ اکسیژن از طریق به اشتراک گذاشتن یکی از اکسیژنها واقع بین دو چهار وجهی به یکدیگر متصل شدهاند.
-
سوروسیلیکات (Sorosilicate) :
اگر دو چهار وجهی از این طریق به یکدیگر متصل شوند، فرمول ترکیب حاصل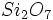 بوده و کانی تیپیک آن آکرمانیت (Akermanite) به فرمول
بوده و کانی تیپیک آن آکرمانیت (Akermanite) به فرمول 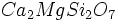 است و چنین ترکیباتی را سوروسیلیکات مینامند.
است و چنین ترکیباتی را سوروسیلیکات مینامند.
-
سیکلوسیلیکات (Cyclosilicate) :
اگر بیش از دو چهار وجهی از طریق به اشترک گذاشتن اکسیژن به یکدیگر متصل شوند، واحد بستهای با ساختار حلقوی تشکیل میشود که ترکیب کلی آن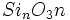 است. در این گروه حلقههایی با شش اتم سیلیسیوم شناخته شده است. بنیتوئیت به فرمول
است. در این گروه حلقههایی با شش اتم سیلیسیوم شناخته شده است. بنیتوئیت به فرمول 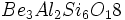 با شش چهار وجهی متصل به هم نمونهای از این نوع سیلیکات است. این گروه از سیلیکاتها را سیکلوسیلیکات مینامند.
با شش چهار وجهی متصل به هم نمونهای از این نوع سیلیکات است. این گروه از سیلیکاتها را سیکلوسیلیکات مینامند.
-
سوروسیلیکات (Sorosilicate) :
-
ساختمان زنجیری:
چهار وجهیهای متصل ، زنجیرههایی با گسترش نامحدود ایجاد میکنند. دو نوع از این ساختمان وجود دارد که باعث ایجاد و ترکیب شیمیایی کم و بیش مختلف میشود.
-
یک زنجیرهای (Single Chain) : در آنها نسبت سیلسیم به اکسیژن ، 1 به 3 است و به وسیله کانیهای خانواده پیروکن مشخص میشوند.
-
جفت زنجیرهای (Double Chain) : چهار وجهیهای موجود در دو زنجیره موازی بطور یک در میان به یکدیگر متصل بوده و نسبت سیلسیم به اکسیژن ، 4 به 11 است و به وسیله کانیهای خانواده آمفیبول
مشخص میشوند. این زنجیرهها دارای گسترش نامحدود بوده و در جهت C ساختمان
بلوری کشیده شده و از طریق عناصر فلزی به یکدیگر متصل هستند. به این گروه
از سیلیکاتها اینوسیلیکات (Inosilicate) میگویند.
-
یک زنجیرهای (Single Chain) : در آنها نسبت سیلسیم به اکسیژن ، 1 به 3 است و به وسیله کانیهای خانواده پیروکن مشخص میشوند.
-
ساختمانهای صفحهای (Sheet Structures) :
در این ساختمان سه اکسیژن هر چهار وجهی با چهار وجهی مجاور به اشتراک گذاشته شده است تا صفحات تخت گستردهای تشکیل شود. در واقع این ساختمان همان ساختمان جفت زنجیرهای اینوسیلیکاتی است که به جای یک جهت در دو جهت بطور نامحدودی گسترش یافته است. در این نوع اتصال ، نسبت سیلسیم به اکسیژن ، 2 به 5 بوده و واحد اصلی در ساختمان تمام میکاها و کانیهای رسی است.
این صفحات ، شبکههایی تخت و شش ضلعی بوجود میآورند که مسئول خواص اصلی کانیهایی از این قبیل است. شکل ظاهری و مشخص شش ضلعی کاذب و همچنین رخ قاعدهای کامل موازی با سطح صفحه نیز ناشی از این ساختمان است. به این گروه از سیلیکاتها فیلوسیلیکات (Phyllosilicate) میگویند.
-
شبکههای سه بعدی :در این ساختمان ، هر چهار وجهی
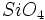 ، تمام گوشههای خود را با سایر چهار وجهیها به اشتراک گذاشته است. نتیجه
این امر تشکیل شبکهای سه بعدی است که در آن نسبت سیلسیوم به اکسیژن ، 1
به 2 میباشد. انواع مختلف سیلیس _ کوارتز ، تریدیمیت (Tridymite)، کریستوبالیت (Cristobalite) دارای این نوع ساختار میباشند. در این ساختمان ، اتم سیلیسیوم چهار ظرفیتی به وسیله دو اتم اکسیژن دو ظرفیتی متعادل شده است.
، تمام گوشههای خود را با سایر چهار وجهیها به اشتراک گذاشته است. نتیجه
این امر تشکیل شبکهای سه بعدی است که در آن نسبت سیلسیوم به اکسیژن ، 1
به 2 میباشد. انواع مختلف سیلیس _ کوارتز ، تریدیمیت (Tridymite)، کریستوبالیت (Cristobalite) دارای این نوع ساختار میباشند. در این ساختمان ، اتم سیلیسیوم چهار ظرفیتی به وسیله دو اتم اکسیژن دو ظرفیتی متعادل شده است.
در این گونه سیلیکاتها بخشی از اتمهای سیلیسیوم به وسیله آلومینیوم جایگزین شده است. بنابراین ساختمان به صورت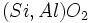 در می آید. جایگزینی
در می آید. جایگزینی 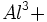 به جای
به جای  حضور یونهای مثبت بیشتری را ایجاب مینماید تا ساختمان از نظر بار الکتریکی همچنان خنثی بماند. فلدسپارها و زنولیتها ، مثالهایی از این نوع سیلیکاتها میباشند که به تکتوسیلیکات (Tektosilicate) شهرت دارند.
حضور یونهای مثبت بیشتری را ایجاب مینماید تا ساختمان از نظر بار الکتریکی همچنان خنثی بماند. فلدسپارها و زنولیتها ، مثالهایی از این نوع سیلیکاتها میباشند که به تکتوسیلیکات (Tektosilicate) شهرت دارند.
شبکه سیلیکاتی
اجزای ساختمان سیلیکاتی (به غیر از O و Si وجود در واحدها) اتمهای بیشتر اکسیژن ، گروههای هیدروکسیل ، مولکولهای آب و کاتیونها به گونهای با گروههای سیلیکاتی نظم و آرایش یافتهاند که ساختمان از نظر مکانیکی ، پایدار و از نظر الکتریکی ، خنثی باشند. پس از سیلیسیوم ، آلومینیوم فراوانترین کاتیون موجود در پوسته زمین بوده و نقش منحصر به فرد خود را ایفا مینماید. آلومینیوم هم در کوردیناسیون چهار و هم در کوردیناسیون شش پایدار است. بنابراین هم میتواند جانشین سیلیسیوم در گروههای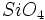 شود و هم به جای کاتیونهای رایج برای کوردیناسیون شش مانند
شود و هم به جای کاتیونهای رایج برای کوردیناسیون شش مانند 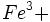 ،
، 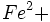 ،
، 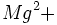 و غیره بنشیند.
و غیره بنشیند.هر سیلیسیوم دارای 4 بار مثبت و هر اکسیژن دارای 2 بار منفی است، بار ظرفیتی وارد بر هر واحد سیلیکاتی که تعیین کننده تعداد بار سایر یونهایی است که میتوانند وارد ساختار شوند، را میتوان به آسانی محاسبه نمود. بدین ترتیب که بار وارده بر یک واحد
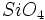 برابر با
برابر با 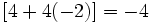 است. به همین ترتیب بار وارده بر یک واحد ساختمانی
است. به همین ترتیب بار وارده بر یک واحد ساختمانی 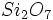 برابر
برابر 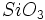 ، -6 برابر 2- ، بر یک واحد
، -6 برابر 2- ، بر یک واحد 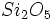 برابر 2- و بالاخره
برابر 2- و بالاخره 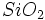 برابر صفر است.
برابر صفر است.